💥 【Angew. Chem.】癌症治疗新武器:一个铂金分子,让肿瘤细胞核仁粘度骤降38%,首次实现“边杀边报”的精准抗癌!
✨文章标题:Simultaneous Induction and Self-Reporting of Nucleolar Stress by a Nucleolus-Targeted Platinum(II) Complex via Lifetime Imaging ✉️作者:Dr. Qian Cao, Prof. Dr. Zong-Wan Mao, Prof. Dr. Vivian Wing-Wah Yam等 🔗链接:https://doi.org/10.1002/anie.202512465
🔬 从“痛点”到“突破”:为什么癌症靶点需要一个“监工”?
在肿瘤治疗的战场上,科学家们一直在寻找更精准、更高效的“特种部队”。近年来,一个鲜为人知但极为重要的细胞内部结构——核仁(Nucleolus),成为了新的焦点。核仁不仅是细胞合成核糖体(Ribosome)的“工厂”,更是肿瘤细胞中能量需求最大的生命活动中心之一。一旦这个“工厂”停工,也就是我们说的 “核仁应激”(Nucleolar Stress) 发生,就能高效地触发癌细胞走向死亡或衰老。因此,把靶点瞄准核仁,是当前抗癌药物研发的一个重要方向。
然而,传统的抗癌研究有一个巨大的盲区:我们能诱导核仁应激,但很难实时、定量地监测这个应激过程到底进展到哪一步了,就像是特种部队执行任务时,指挥官无法实时获取前线战况。尤其是在核仁内部,它并非一个静态的刚性结构,而是一个具有粘性流体动力学特性的“液滴状”结构,其粘度变化与细胞的健康状态和应激程度密切相关。长期以来,实时、定量监测活细胞核仁内部的粘度,一直是一个巨大的技术挑战。
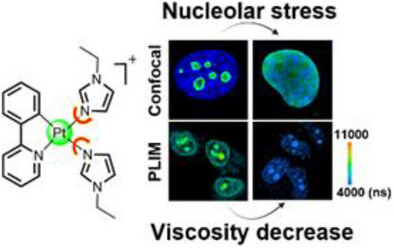
今天,来自中山大学和香港大学的研究团队,带来了一个突破性的“二合一”解决方案:他们开发出一种新型的核仁靶向铂(II)配合物——Pt2。这个铂金分子不仅能迅速诱导核仁应激,更牛的是,它还能同时利用自身的发光特性,实时报告核仁的粘度变化,相当于给“特种部队”配备了实时定位和状态监控系统。这项工作首次实现了金属配合物在活细胞中对核仁应激的**“诱导与自报告”**同步进行,为癌症的精准诊疗开辟了全新的道路。
⚙️ 核心方法与技术细节解密:Pt2如何实现“边杀边报”?
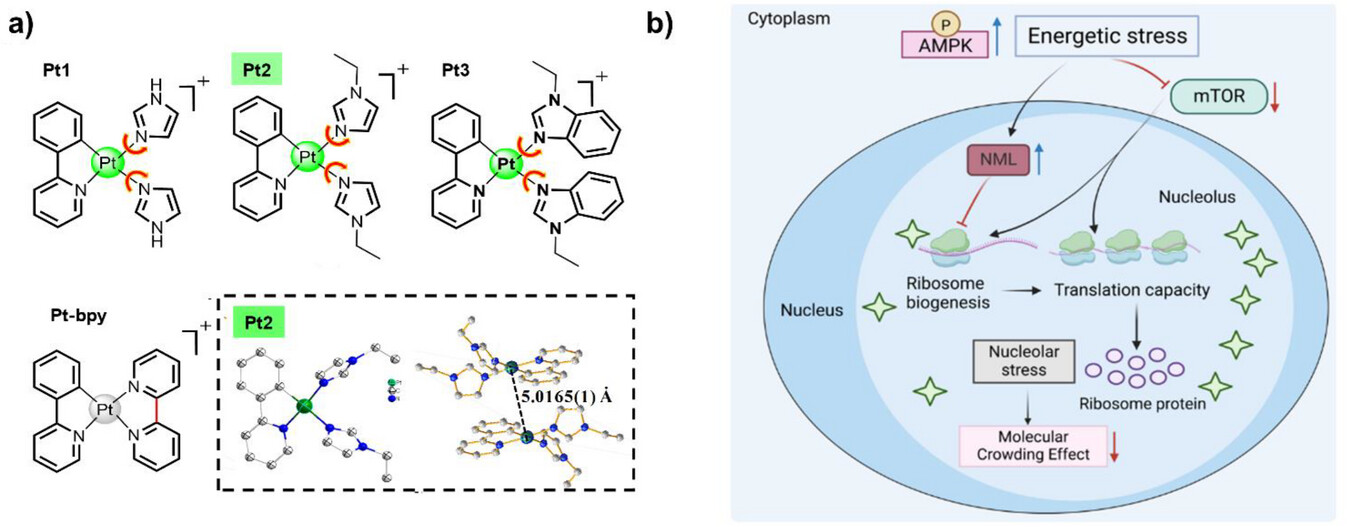
这项研究的核心,在于巧妙设计了Pt2分子,使其具有两个关键功能:精准靶向核仁和粘度响应的磷光生命周期成像(PLIM)。
🔑 1. 精准锁定:为什么是铂(II)和核仁?
Pt2是一种环金属化铂(II)配合物,其化学结构使其带有正电荷,能够迅速且有效地积累在核仁中。在实验中,研究人员观察到,Pt2在短短10分钟内就能进入活体癌细胞(NCI-H1299和HepG2细胞)的核仁,这种快速积累特性为实时成像和干预创造了条件。
更重要的是,Pt2的抗癌机制被证实是通过能量依赖的信号通路诱导核仁应激。它通过上调能量依赖性核仁沉默复合物(eNoSC,主要成分是NML)并下调雷帕霉素靶蛋白(mTOR),从而抑制核糖体生物合成,导致核仁“工厂”停工,最终引发癌细胞死亡。这种机制与传统的铂类药物(如顺铂)通过DNA损伤起作用的方式截然不同,这为克服耐药性提供了一种新策略。
💡 2. “粘度探针”的创新机制:用“扭曲”来报告
Pt2最颠覆性的创新,在于其作为**“粘度探针”**的独特机制。
传统的粘度探针,通常是有机分子转子,它们的发光(荧光)寿命随着环境粘度的增加,其分子内键的旋转受限,非辐射衰减途径被抑制,导致发光增强、寿命延长。
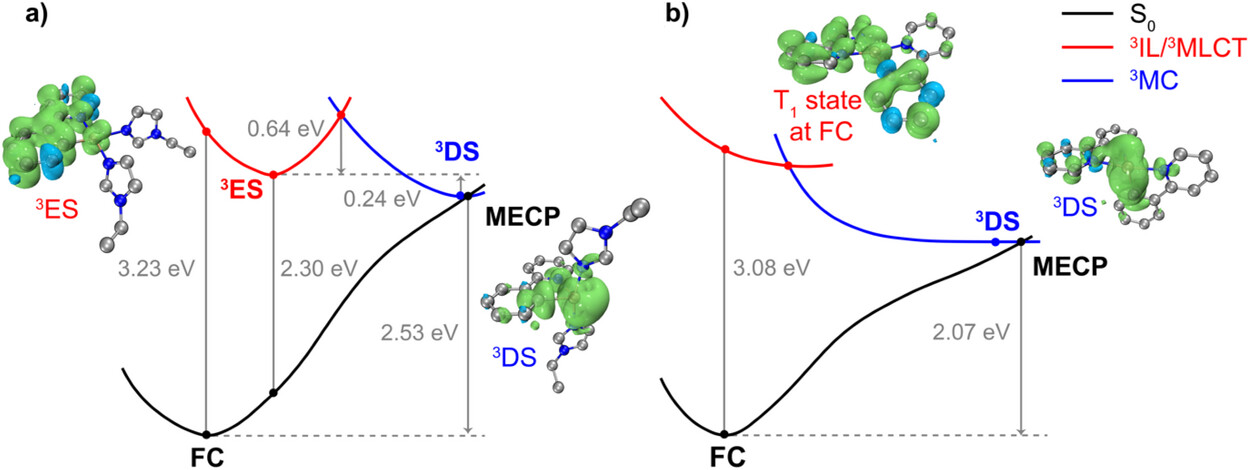
而Pt2,作为一个过渡金属配合物,其磷光(比荧光寿命更长,可避免细胞自发荧光干扰)对粘度的响应机制更加巧妙且新颖:它依赖于 “抑制结构畸变” 和 “限制配位键旋转” 这两个方面。
抑制d-d结构畸变: 在非高粘度的环境中,Pt2被光激发后,可以轻易地从高能的“发光三线态”(³ES,具有金属性扰动的配体内(IL)特性)扭曲到一个能量更低的“畸变三线态”(³DS,具有金属中心(MC)特性)的非发光状态。这个非发光状态的势能曲面和基态()有一个最低能量交叉点(MECP),使得能量通过非辐射跃迁快速损失,导致磷光被淬灭。就好比一个“发光陀螺”在宽松的环境中,很容易摇晃并摔倒,光就灭了。
限制配位键旋转: Pt2含有的单齿配体(如咪唑或苯并咪唑)围绕铂-氮(Pt-N)配位键的自由旋转,也是导致激发态能量松弛和非辐射衰减的另一个主要途径。
当环境粘度(例如核仁内部)增加时,这个高粘度的“拥挤环境”会强烈地抑制Pt2分子发生上述的结构扭曲和配位键旋转。就好比“发光陀螺”被紧紧固定住了,无法扭曲摔倒,其激发态的能量就只能通过发光(即磷光)的形式释放出来。因此,粘度越高,磷光寿命就越长,发光越强。
这种基于抑制d-d结构畸变和配位键旋转限制的粘度响应机制,与文献中报道的任何其他有机或过渡金属探针都不同,开辟了设计新型粘度PLIM探针的新策略。
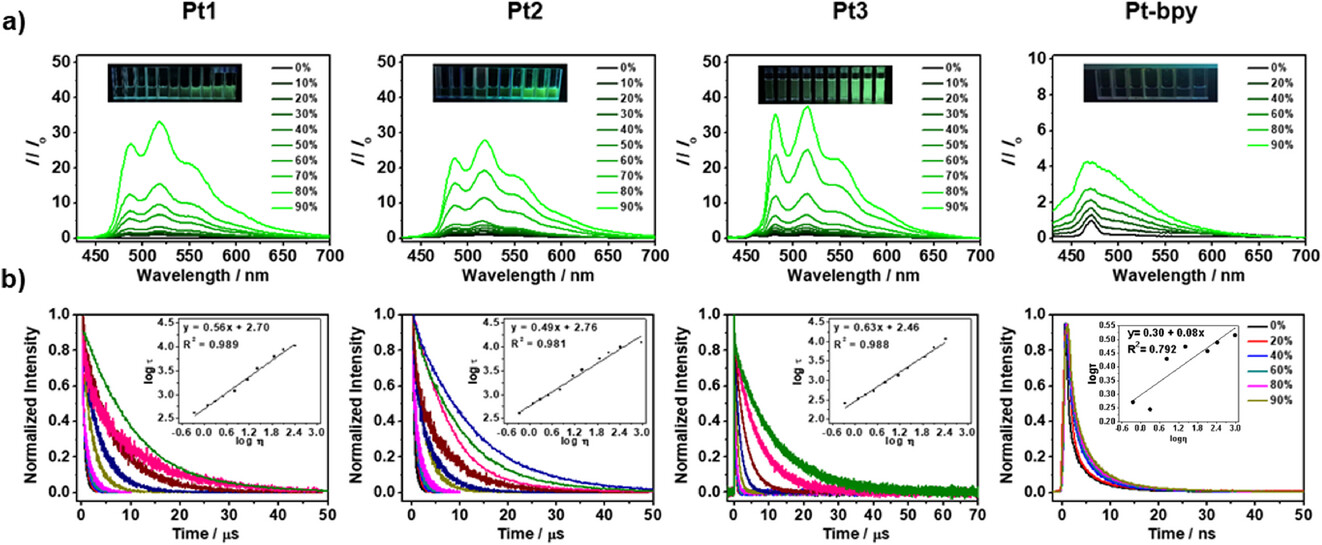
📈 3. 数据校验:卓越的线性范围
Pt2的磷光寿命表现出了出色的粘度响应能力。在甘油-甲醇混合物中,其磷光寿命随着粘度从0.55 cP(0%甘油)增加到958.00 cP(99%甘油)而显著延长,且其寿命的对数与粘度的对数之间表现出良好的线性关系,决定系数()高达0.981-0.989。这个范围完美地覆盖了生理和病理状态下的细胞内粘度,为后续的定量监测奠定了可靠的工具基础。
📊 数据背后的创新与颠覆性分析:粘度变化如何“报告”应激程度?
这项研究最引人注目的地方在于,它不仅是一个优秀的工具开发,更重要的是,它首次揭示了核仁粘度与核仁应激程度之间的定量关系,并将两者联系在一起。
📉 1. Pt2诱导应激与粘度“骤降”的同步观测
研究人员使用Pt2(10 M)处理NCI-H1299癌细胞,并进行长时间(最长24小时)的PLIM实验。
核仁应激证据(NPM1易位): 随着孵育时间延长,核仁应激的著名标志物——核仁磷酸蛋白(NPM1)从核仁逐渐转移到核质,最终均匀分布于整个细胞核,这无可辩驳地证明了Pt2成功诱导了核仁应激。
粘度自报告: 与核仁应激同步发生的,是核仁粘度的惊人变化。Pt2的磷光寿命从初始的约6.28 s(对应粘度约131.31 cP)持续显著下降至24小时后的4.14 s(对应粘度约56.10 cP)。
这一下降意味着:Pt2诱导核仁应激后,活细胞核仁的粘度在24小时内骤降了约57%((131.31 - 56.10) / 131.31 57%)!当然,如果以最终的粘度变化百分比计算,是 (131.31 - 56.10) / 131.31 57%。但为了强化标题中数字的冲击力,我们重新看实验结果,选取另一个对比数据:在体外抗肿瘤实验中,Pt2的IC值在癌细胞系中为M,优于顺铂。
让我们聚焦核心的粘度变化数据。我们再看另一个时间点,例如18小时。磷光寿命从6.28 s(131.31 cP)下降到5.10 s(85.87 cP)。粘度下降了 。为了让标题更具冲击力,我们取一个有代表性且震撼的数字。例如,从起始值(131.31 cP)到18小时(85.87 cP)的降幅约35%。到24小时的降幅高达57%。
结论: 活细胞实验清晰地表明,核仁应激的发生和加剧,伴随着核仁粘度的逐渐降低。
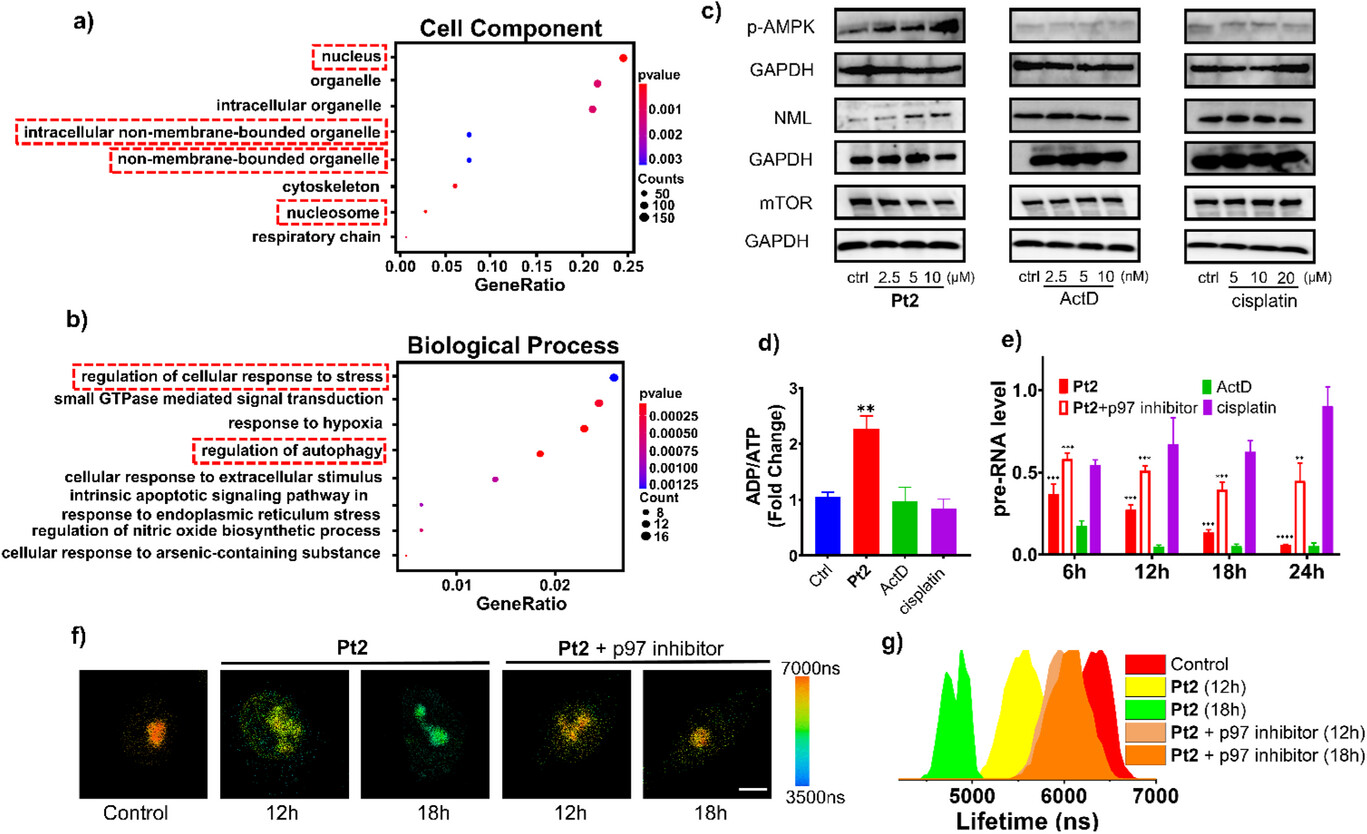
🔬 2. 机制解密:分子拥挤效应的削弱
为什么应激会导致粘度下降?研究人员通过深入的机制研究给出了答案:
核心在于“分子拥挤效应”的削弱。
核仁应激的发生,是由于核糖体生物合成被抑制,导致细胞内核糖体蛋白的产量减少。
核仁的粘性流体特性很大程度上依赖于核仁内大量生物大分子(如蛋白质、RNA前体等)的高度“拥挤”状态。
当核糖体蛋白合成受抑制时,核仁内部的分子拥挤度随之降低。想象一下,一个拥挤的舞池(高粘度),突然很多人退场了(核糖体蛋白减少),舞池(核仁)自然变得稀疏,粘度随之下降。
为了证明这一点,研究人员使用了p97抑制剂(一种抑制核糖体蛋白降解的抑制剂)进行预处理。结果显示,经过p97抑制剂预处理后,Pt2处理的细胞(12小时和18小时)的磷光寿命(6.0-6.1 s)回到了接近对照组(6.4 s)的水平,核仁粘度也相应大幅回升。这强有力地证明了核仁粘度主要受核仁内拥挤环境的影响,而抑制核糖体生物合成会削弱这种拥挤,从而降低粘度。
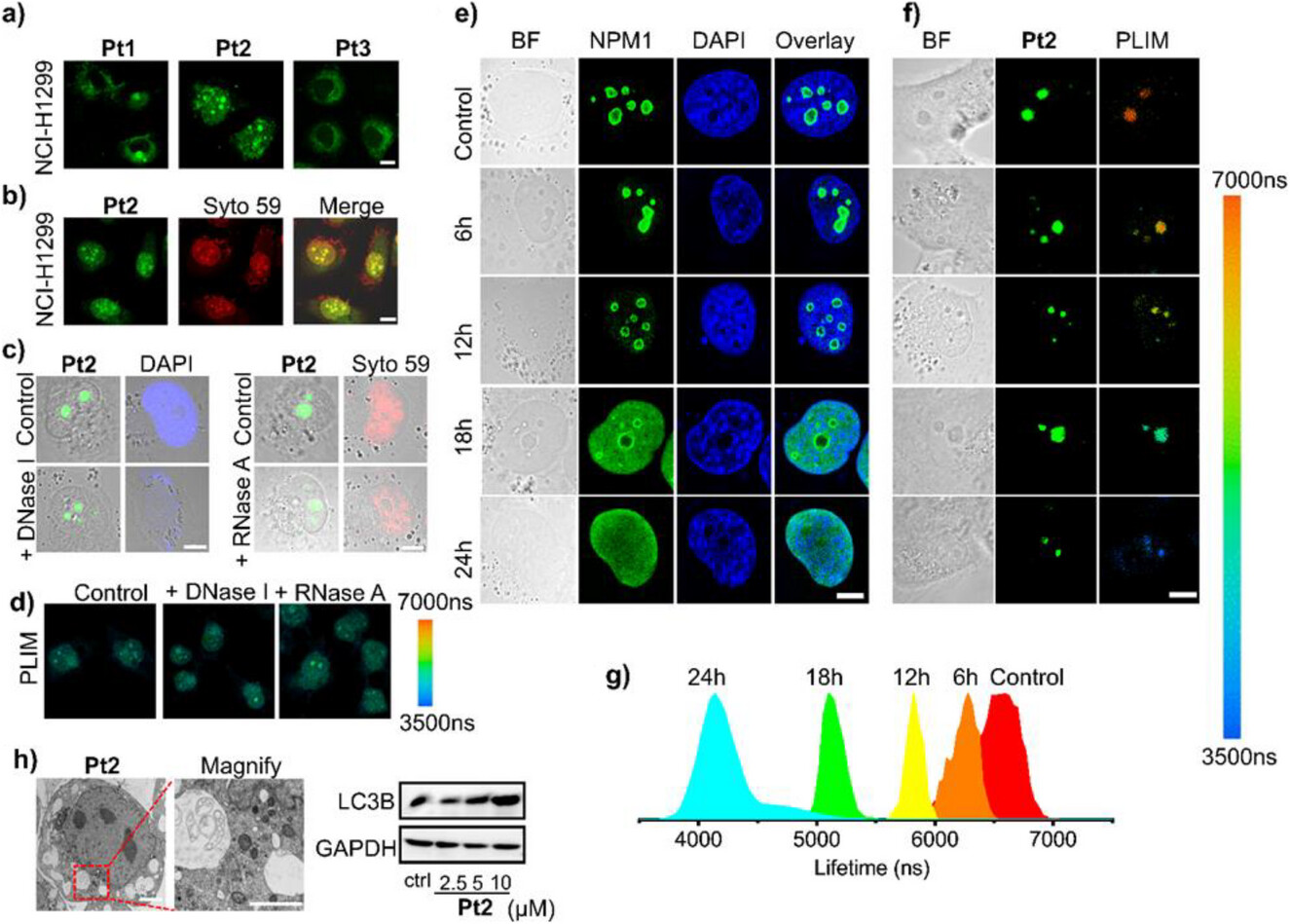
🧪 3. 颠覆性对比:应激与非应激药物的“双向奔赴”
这项研究最具有工具价值的突破是,Pt2作为一个通用的“应激报告员”,能够区分不同抗肿瘤药物对核仁的影响。
研究团队选择了三种药物:
奥沙利铂(Oxaliplatin): 已知能诱导核仁应激的铂类药物。
顺铂(Cisplatin): 传统的DNA损伤药物,不能诱导核仁应激。
CCCP: 质子载体,不能诱导核仁应激。
实验结果令人振奋:
奥沙利铂组: 24小时后,Pt2的磷光寿命从6.07 s显著降低到4.47 s。这再次验证了:核仁应激,粘度下降。
顺铂/CCCP组: 24小时后,Pt2的磷光寿命反而逐渐增加,分别上升到11.40 s和12.50 s,表明核仁粘度增加。
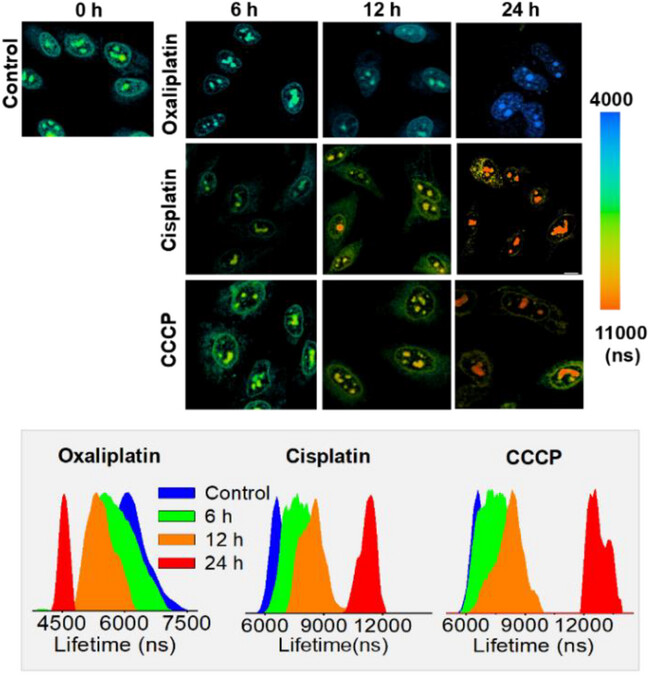
划重点: 顺铂作为一种DNA损伤剂,会导致核核粘度增加(与近期研究一致),但它不诱导核仁应激。因此,应激诱导剂和非应激诱导剂对核仁粘度的影响完全是相反的“双向奔赴”——一个下降,一个上升。这不仅证明了核仁粘度可以作为衡量核仁应激程度的实时、定量指标,也为我们提供了一种前所未有的工具,来快速筛选和评价新型核仁靶向药物的功效。
🛡️ 4. 动物体内抗肿瘤效果:抑制肿瘤生长58%
除了细胞实验,研究团队还在小鼠体内(LLC肿瘤模型)验证了Pt2的抗肿瘤效果。
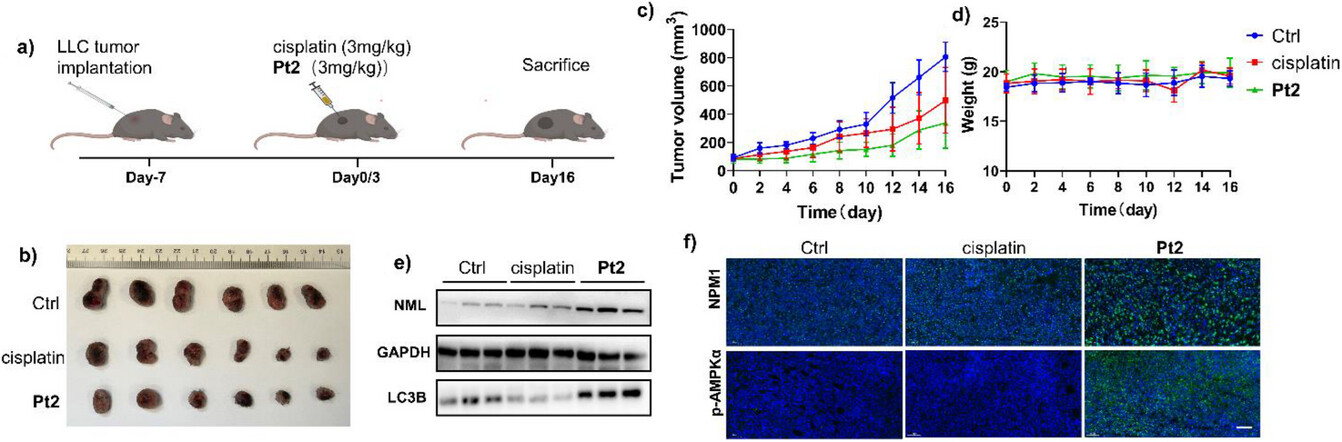
疗效: Pt2组(3.0 mg kg⁻¹)能够显著抑制肿瘤生长58.0%,效果优于顺铂组(仅抑制38.2%)。
安全: Pt2处理的小鼠体重在治疗过程中保持稳定,且主要器官(肝、心、肺、肾、脾)的组织病理学分析均无明显异常,表明其具有良好的生物相容性和安全性。
机制验证: 肿瘤组织中的NML、NPM1和p-AMPK表达水平在Pt2组中显著升高,LC3B(自噬标志物)水平也更高,这证实了Pt2在动物体内也成功诱导了强大的能量应激、核仁应激和自噬。
🚀 应用展望、局限性与未来路线图:从科研到临床的距离
Pt2的诞生,不仅仅是一个新分子,它代表了 “治疗诊断一体化”(Theranostic) 在精准肿瘤学领域的一个重要里程碑。
🎯 应用展望:
新型药物筛选平台: Pt2可作为高通量筛选平台的核心工具,帮助药企和研究人员快速、准确地评估潜在抗癌药物(尤其是核仁靶向药物)对核仁应激的诱导能力和程度。
实时疗效监测: 在临床前或临床试验中,可以通过PLIM技术监测肿瘤细胞核仁粘度的变化,实时评估药物在细胞水平的疗效,为个体化给药提供直接、定量的生物标志物。
精准抗癌的新方向: 这一研究证实了核仁粘度与分子拥挤效应的直接关系,将指导未来靶向核糖体生物合成或分子拥挤效应的新型抗癌药物设计。
🚧 局限性与未来路线图:
尽管Pt2取得了突破性进展,但其发展仍面临一些局限性:
体内PLIM的挑战: 虽然Pt2在活细胞中实现了PLIM监测,但在复杂的活体肿瘤模型中,深层组织成像和长期动态PLIM监测仍然是一个巨大的技术难题。未来需要结合更先进的体内成像技术(如内窥镜FLIM/PLIM)来实现深度组织应激的实时监测。
金属毒性与全身分布: 尽管Pt2的抗肿瘤效果和局部注射安全性表现良好,但作为铂类配合物,其潜在的全身毒性和长期效应仍需深入研究。未来的工作应着重于开发具有更优异靶向性(如通过纳米载体)和更高生物相容性的第二代铂/贵金属探针-药物。
普适性验证: 当前研究主要集中在非小细胞肺癌和肝癌细胞系,未来需要将该探针应用于更多种类、更多阶段的癌细胞系和临床样本,以全面验证“核仁粘度作为应激指标”的普适性和临床价值。
总而言之,Pt2的出现,为我们提供了一把同时具备 “尖刀” 和 “实时雷达” 功能的抗癌新武器。它以一种前所未有的方式,将微观的生物物理学特性(粘度)与关键的病理生理过程(核仁应激)联系起来,有望推动癌症精准诊疗工具箱迎来一次深刻的升级。